图为 国家药监局医疗器械技术审评中心(CMDE)主文档登记信息公示
2021年国家药监局发布了《国家药监局关于医疗器械主文档登记事项的公告》,正式建立了医疗器械主文档登记制度。当医疗器械厂商在进行医疗器械注册申请时,主文档所有者将向注册申请人出具授权书。监管机构对医疗器械申报资料进行审评时,可依据授权书调阅已登记的主文档资料进行审评。
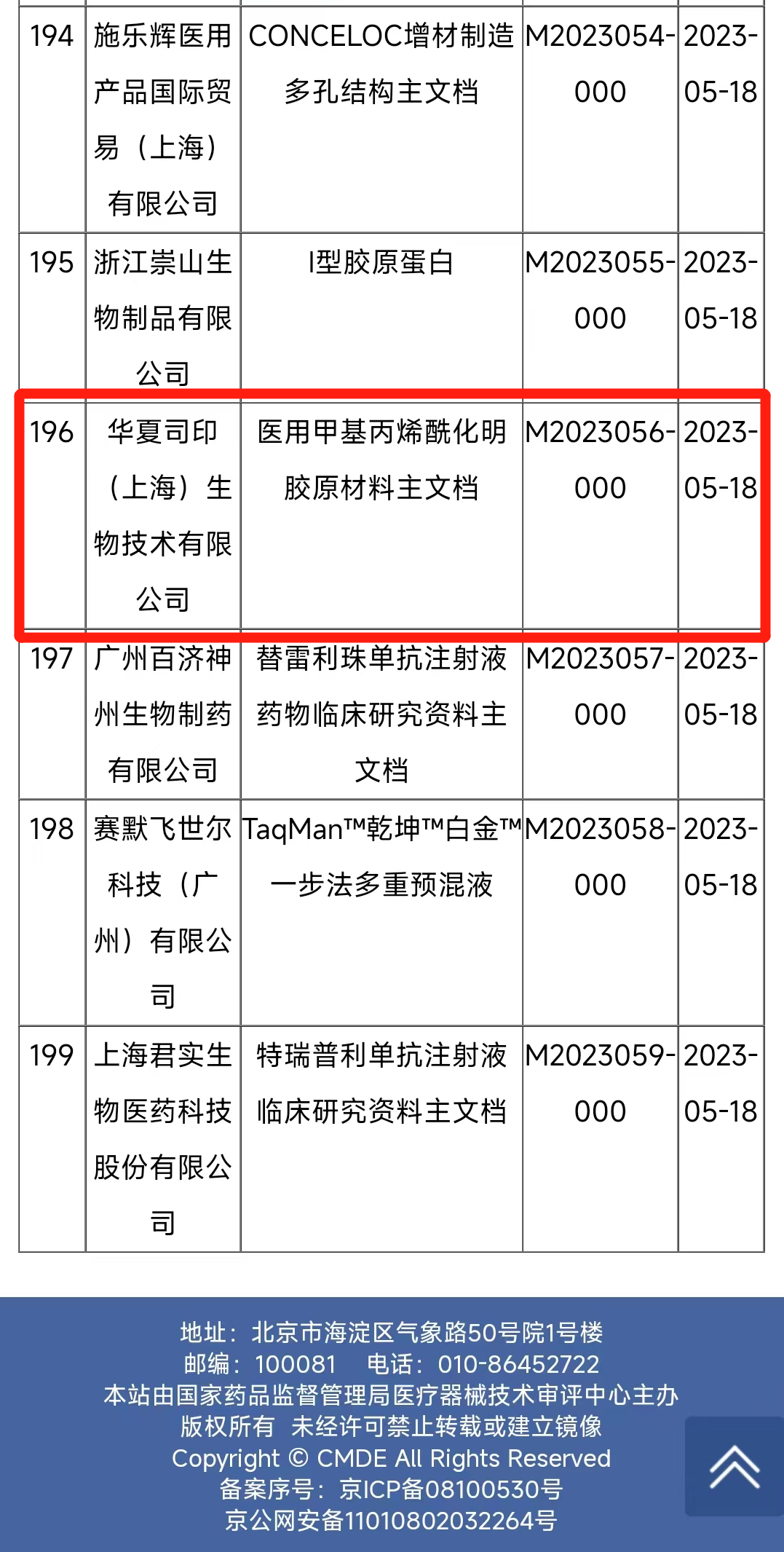
华夏司印登记的医用级GelMA原料符合YY/T 1453-2016《组织工程医疗器械产品I型胶原蛋白表征方法》和《中华人民共和国药典》(2020版)等国家相关质量标准要求,可根据客户需求定制甲基丙烯酰基取代度(可选40%、60%、80%和100%),甲基丙烯酸(MAA)残留量可控制在100 µg/g以下,内毒素可控制至0.5 EU/mg以下,属于高质量医用级甲基丙烯酰化明胶原料。
GelMA已被研究人员作为基础支撑材料,广泛应用于骨、软骨、皮肤、肌腱、血管、角膜等的修复和再生的研究。基于GelMA,华夏司印开展了软骨再生水凝胶、骨软骨3D打印支架和髋关节软骨内衬移植物等临床项目。本次“医用级GelMA”原材料主文档的登记,为华夏司印临床项目的转化奠定了坚实的基础,同时也表明本产品可作为国内其他医疗器械厂商产品设计和开发的标准原材料之一,大大节省了器械产品的开发时间,助推生物3D打印和再生医学的发展。




